Niveau : secondes générales
Prérequis : loi de Boyle-Mariotte , calculs de volumes, notion de masse molaire moléculaire, unité de température kelvin
Il y a de l’eau dans l’air, mais en quelle quantité ?
Dans ce cours soutien scolaire physique chimie en ligne spécial seconde, nous proposons de résoudre ce problème en considérant :
un séjour de surface d’aire : ![]() ,
,
une hauteur sous plafond : ![]() ,
,
une température de la pièce : ![]() ,
,
un taux d’hygrométrie ![]() .
.
Nous donnons aussi un graphique représentant la pression de vapeur saturante en eau en fonction de la température :
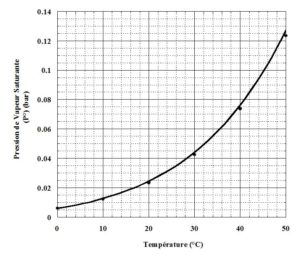
Nous aurons besoin des formules suivantes :
Taux d’hygrométrie : ![]() où les pressions sont données en pascal.
où les pressions sont données en pascal.
Loi des gaz parfait (loi de Boyle-Mariotte « améliorée ») : ![]() avec la pression
avec la pression ![]() en pascal, le volume
en pascal, le volume ![]() en mètre cube, le nombre de moles
en mètre cube, le nombre de moles ![]() , la constante des gaz parfaits
, la constante des gaz parfaits ![]() et la température
et la température ![]() en kelvin.
en kelvin.
Résolution
Masses molaires atomiques de l’oxygène et de l’hydrogène : ![]() et
et ![]()
Etape 1 : détermination du volume du séjour
Le volume du parallélépipède rectangle de dimensions ![]() et
et ![]() est simplement obtenu en mètre cube par
est simplement obtenu en mètre cube par ![]() soit
soit ![]()
Etape 2 : détermination de la pression partielle d’eau
Le graphique nous permet de déterminer la pression de vapeur saturante dans une atmosphère à 20 °C en bar.
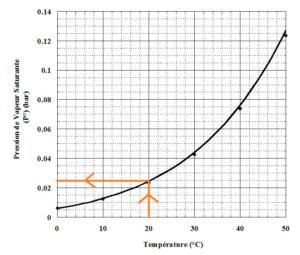
Nous lisons ![]() soit en utilisant le système international d’unités :
soit en utilisant le système international d’unités : ![]()
La formule donnée dans l’énoncé nous permet d’écrire en remplaçant 60 % par son équivalent ![]() et la pression de vapeur saturante en pascal par
et la pression de vapeur saturante en pascal par ![]() :
:
![]() où
où ![]() est la pression partielle d’eau dans l’air en pascal.
est la pression partielle d’eau dans l’air en pascal.
Nous en déduisons ![]()
Etape 3 : détermination du nombre de moles contenu dans le séjour
La loi des gaz parfaits s’écrit :
![]() soit en exprimant le nombre de moles
soit en exprimant le nombre de moles ![]() en fonction des autres paramètres
en fonction des autres paramètres ![]()
La température doit être donnée en degré kelvin : ![]()
En remplaçant par les valeurs numériques :
![]()
Etape 4 : détermination de la masse d’eau dans le séjour
Nous avons besoin de connaître la masse molaire moléculaire de l’eau ![]()
![]()
Il est alors simple de connaître la masse d’eau contenue dans le séjour :
![]()





Répondre
Want to join the discussion?Feel free to contribute!