 Dis-moi, Lambö, comment se forment les bulles ? Réponses dans ce cours en ligne de physique chimie spécial lycée, niveau première S – terminale S.
Dis-moi, Lambö, comment se forment les bulles ? Réponses dans ce cours en ligne de physique chimie spécial lycée, niveau première S – terminale S.
Très chers élèves, les fêtes approchent !
… et avec elles, son lot de cadeaux, décorations, festivités, et bien sûr, de repas copieux et arrosés (poour les plus grands bien entendu). « Ne pensons pas à l’été prochain, et laissons-nous grossir un peu ! » me dis-je en buvant une coupe de champagne, boisson la plus festive qui soit. C’était sans compter mon esprit scientifique qui mourra alors d’envie de vous expliquer :
Qu’est-ce qu’une bulle ?
Comment se forme une bulle de champagne ?
… En effet, un gaz occupant un espace parfaitement sphérique, dans un liquide (comme dans mon délicieux champagne), ou simplement protégé par une couche de liquide et flottant dans l’air libre (comme pour les bulles de savon)… Quelle curieuse idée ! Quel prodige !
Prenons le cas de bulles de gaz dans un liquide (comme dans mon champagne… ah tiens je l’ai fini, oups). Ici, un gaz se retrouve ‘prisonnier’ dans un liquide. Comme vous le savez surement, la nature recherche toujours l’équilibre : la forme sphérique permet la plus petite surface possible par rapport au volume contenu, nécessitant ainsi le minimum d’énergie pour être maintenue. Voilà, tout simplement, pourquoi elles sont rondes !
Comment se forme une bulle de savon ?
Passons maintenant aux bulles à l’air libre, telles les bulles de savon. C’est un cas un peu plus compliqué !
Pour commencer, abordons une notion nouvelle : la tension superficielle.
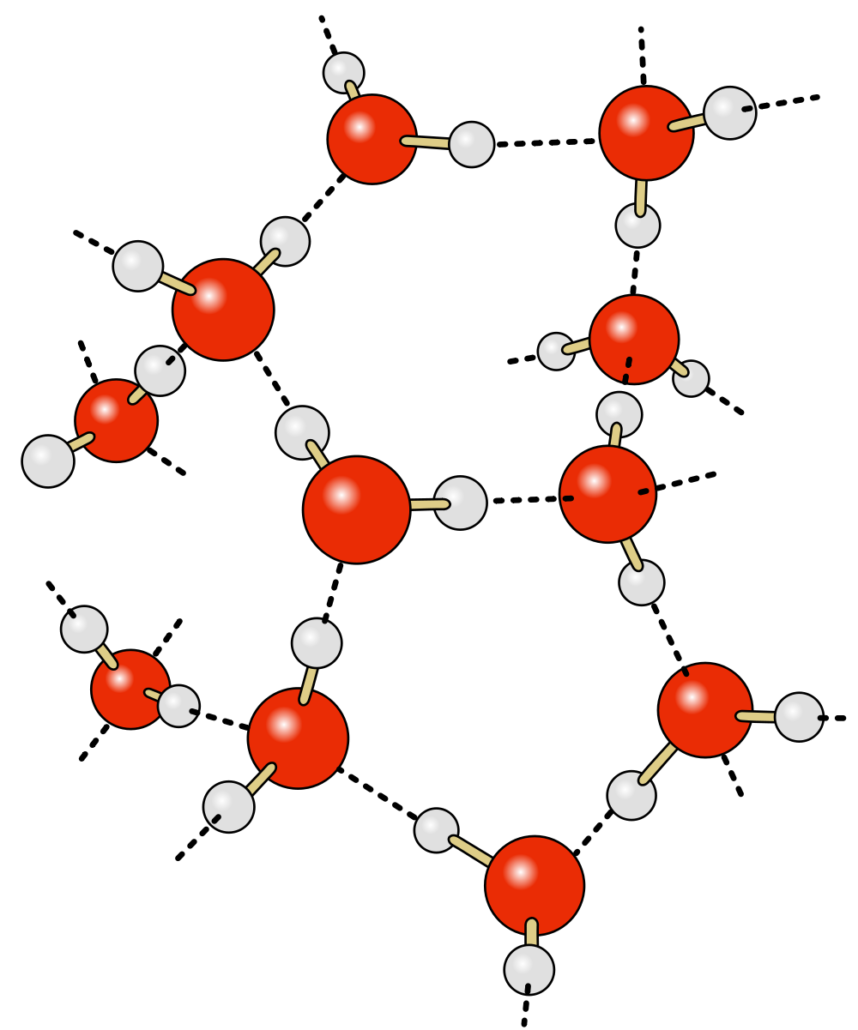
Comme vous le savez, la cohésion de la matière est notamment due aux interactions entre les atomes et/ou molécules le composant. Prenons un exemple simple : l’eau, de molécule H2O. L’eau est constituée d’un nombre immense de ces molécules. Entre ces molécules, existent des interactions de nature électrostatique (liaisons hydrogènes, etc.), assurant la cohésion de l’eau, lui conférant son état macroscopique, qu’il soit liquide ou solide.
Chaque molécule étant, bien sûr, entourée d’un grand nombre de ses camarades… mais vous êtes vous déjà posé la question des molécules à la surface de l’eau liquide, par exemple ? En effet, celles-ci ont nettement moins de voisines !
En réponse à ce phénomène, l’interaction entre ces molécules de surface est plus importante : il s’agit de la tension superficielle !
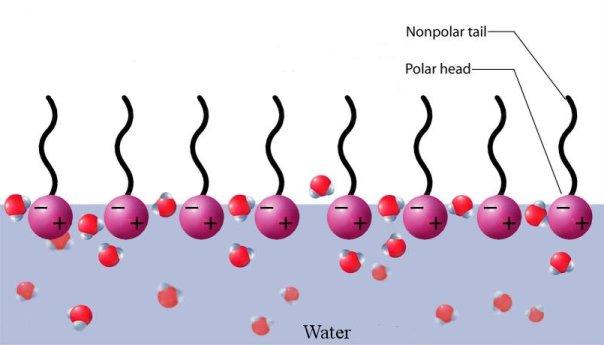
Ajoutons un autre élément : la présence de tensio-actifs !
En effet, les molécules présentes dans le savon ont la particularité d’avoir une extrémité hydrophile et une autre hydrophobe. Elles vont donc se lier en grand nombre à l’eau, par leurs têtes hydrophiles, les têtes hydrophobes ‘repoussant’ l’eau, ce qui aura pour effet de tendre à la formation d’une surface plane !
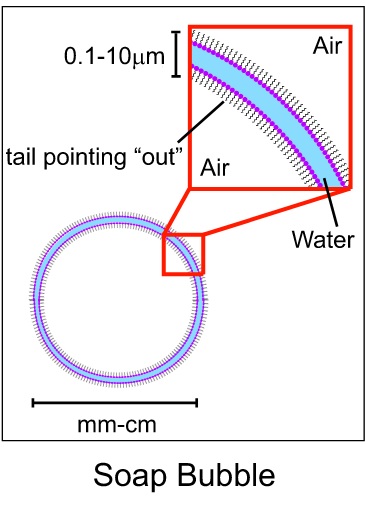 Ceci, couplé au phénomène de tension superficielle, va mener, dans de bonnes conditions, à la création d’une bulle : une fine surface d’eau, ‘encadrée’ par les molécules du savon, se ‘repliant’ sur elle-même en se refermant !
Ceci, couplé au phénomène de tension superficielle, va mener, dans de bonnes conditions, à la création d’une bulle : une fine surface d’eau, ‘encadrée’ par les molécules du savon, se ‘repliant’ sur elle-même en se refermant !
Et voilà comment se forment les bulles de savon !
Je vous laisse désormais retourner aux préparatifs des fêtes, et également méditer sur cette citation de l’auteur Gilles Martin-Chauffier :
» La vérité est une bulle de champagne, elle remonte toujours à la surface. »
Retrouvez d’autres articles de soutien scolaire en ligne niveau lycée en sciences, afin de préparer au mieux exposés, TP et baccalauréat. N’hésitez pas à nous suivre sur notre page Facebook afin d’être informés au jour le jour des nouvelles parutions autour de l’aide aux devoirs.






Répondre
Want to join the discussion?Feel free to contribute!