 Dans le cadre de vos révisions bac série S, l’article de Lambö, E-Prof de physique chimie en ligne, porte sur la chimie cinétique.
Dans le cadre de vos révisions bac série S, l’article de Lambö, E-Prof de physique chimie en ligne, porte sur la chimie cinétique.
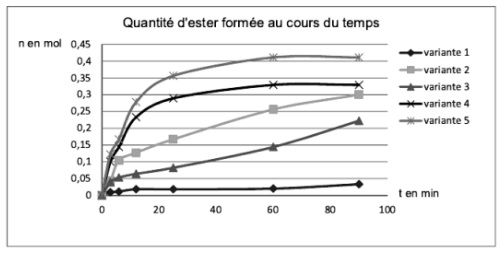
On réalise en laboratoire la réaction d’estérification entre l’acide éthanoïque et le butan-1-ol conduisant à la formation d’éthanoate de butyle. Afin d’étudier la vitesse de cette réaction, on en fait varier les paramètres, afin d’avoir 5 variantes de la même expérience.
La courbe ci-dessous montre la quantité d’ester formée au cours du temps pour chacune de ces variantes.
Voici, dans le désordre, les 5 variantes expérimentales utilisées ce jour-là :
A – Température = 50°C, avec ajout d’acide sulfurique.
B – Température = 40°C, aucun ajout.
C – Température = ambiante, aucun ajout.
D – Température = 50°C, avec ajout d’acide sulfurique et un excès en butan-1-ol.
E – Température = 50°C, aucun ajout.
Attribuer à chaque courbe (1 à 5) ses conditions (A à E), et justifier !
Paramètres ayant une influence sur la vitesse d’une réaction chimique
Commençons par rappeler les principaux paramètres ayant une influence sur la vitesse d’une réaction chimique :
-
la concentration en réactifs
-
la température
-
la présence d’un catalyseur
Pour vous aider à les retenir (et les comprendre !), voici une analogie que j’aime utiliser pour me rappeler de ces paramètres : imaginons un manège d’auto-tamponneuses. Les voitures sont ici les molécules, et une réaction chimique serait la rencontre entre 2 voitures.
- La concentration en réactifs : plus il y a de gens conduisant des voitures dans le manège, plus il y a de chances qu’elles se rencontrent et se percutent, logique !
- La température : vous avez vu en cours qu’il s’agit d’une grandeur correspondant à l’agitation des molécules. Ici, considérons que la température est l’ambiance dans le manège : plus l’ambiance est agitée, plus les gens sont motivés, et plus il y aura de chocs entre les voitures !
- Présence d’un catalyseur : ici, imaginons que ce serait une boisson énergétique servie à l’entrée du manège. Si toutes les personnes présentes dans le manège en ont bu, cela augmentera encore les possibilités de chocs entre les voitures !
Maintenant que nous avons fait ce rappel, revenons à notre exercice.
En observant les 5 variantes expérimentales A à E, on va pouvoir les classer par ordre croissant de vitesse de réaction, en analysant leurs paramètres :
- B > C : car ils ont les mêmes paramètres sauf la température, supérieure pour B.
- E > B : car ils ont les mêmes paramètres sauf la température, supérieure pour E.
- A > E : car ils ont les mêmes paramètres mais A implique un catalyseur (l’acide sulfurique, qui n’intervient pas dans la réaction, décrite dans l’énoncé).
- D > A : car ils ont les mêmes paramètres sauf un excès de réactif pour D.
… Notez que pour comparer les variantes, je procède 2 à 2 : en effet, on ne peut comparer des expériences que si l’on change un seul paramètre à la fois !
 Il suffit donc d’associer ces conditions aux courbes allant de la plus lente à la plus rapide : 1 – 3 – 2 – 4 – 5. Ainsi :
Il suffit donc d’associer ces conditions aux courbes allant de la plus lente à la plus rapide : 1 – 3 – 2 – 4 – 5. Ainsi :
1 – C
2 – E
3 – B
4 – A
5 – D
… Et voilà ! En espérant que cela vous aura permis de mieux comprendre l’influence des paramètres sur la cinétique chimique !





Répondre
Want to join the discussion?Feel free to contribute!