Niveau : premières scientifiques et sciences et techniques
Prérequis : notions de base sur les chaleur latente de changement d’état et sur la capacité massique d’un corps.
 Comme dans tous dispositifs d’échanges de chaleur (appareils réfrigérants ou chauffants), l’objectif est de tirer profit au maximum de la chaleur (énergie thermique) contenue dans un fluide.
Comme dans tous dispositifs d’échanges de chaleur (appareils réfrigérants ou chauffants), l’objectif est de tirer profit au maximum de la chaleur (énergie thermique) contenue dans un fluide.
Dans ce cours de physique chimie en ligne comparons les quantités d’énergie mises en oeuvre lors d’un changement de température d’un gaz et lors d’un changement d’état.
Données d’étude
La capacité thermique de l’eau liquide est ![]()
La capacité thermique de la vapeur d’eau est ![]()
L’enthalpie de vaporisation de l’eau (couramment appelée chaleur latente de vaporisation) est ![]()
Questions
1- Calculer la quantité d’énergie libérée en joule lors du refroidissement de 200 °C à 100 °C de 250 g de vapeur d’eau ?
2- Calculer la quantité d’énergie libérée en joule lors de la condensation de 250 g de vapeur d’eau ?
3- Calculer la quantité d’énergie libérée en joule lors du refroidissement de 100 °C à 0 °C de 250 g d’eau liquide ?
4- Déduire une analyse de la pertinence de la technologie des chaudières à condensation ?
Réponses
Les unités utilisées sont celles du système international (masses en kilogramme, températures en kelvin et chaleurs en joule).
1- La quantité d’énergie (chaleur) reçue lors du passage d’une température ![]() à une température
à une température ![]() d’un corps pur de capacité thermique
d’un corps pur de capacité thermique ![]() et de masse
et de masse ![]() est donnée par la formule
est donnée par la formule ![]()
Note : dans la suite, comme ce ne sont pas les valeurs absolues des températures mais les différences de températures qui entrent en jeu, nous pourrons travailler directement en °C sans avoir à convertir en K.
En effet, bien que 100°C et 200°C valent respectivement 373,15 K et 473,15 K, les écarts restent identiques : ![]()
Dans cette première question, lors du passage de 200°C à 100°C, ![]() quelle que soit l’unité choisie.
quelle que soit l’unité choisie.
Nous écrivons donc pour la chaleur reçue par la vapeur : ![]()
Le signe négatif nous indique qu’il y a eu libération et non acquisition de chaleur.
La chaleur libérée par le refroidissement est de 46,25 kJ
2- La quantité d’énergie reçue lors du passage d’une masse ![]() d’un corps pur de chaleur latente
d’un corps pur de chaleur latente ![]() de l’état liquide à l’état gazeux est donnée par la formule
de l’état liquide à l’état gazeux est donnée par la formule ![]() .
.
Comme ici nous considérons la transformation inverse, la quantité reçue est ![]()
La quantité libérée lors de la condensation est de 564,25 kJ
3- En procédant de la même manière que pour la question 1, pour une même diminution de 100 °C de la température, nous calculons ![]()
La chaleur libérée lors du refroidissement de l’eau liquide est de 104,625 kJ
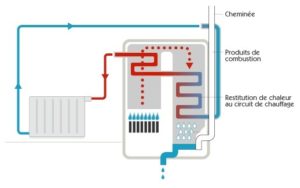 4- Suite à cette étude quantitative, nous pouvons conclure qualitativement :
4- Suite à cette étude quantitative, nous pouvons conclure qualitativement :
Les quantités d’énergie mises en oeuvre sont généralement bien plus importantes lors des changements d’état que lors des changements de température.
Ainsi, nous observons que la quantité de chaleur contenue dans la vapeur d’eau générée par une chaudière est tout à fait conséquente. Rejeter les gaz brûlants contenant de la vapeur d’eau produite par la combustion du gaz dans l’atmosphère conduit à une perte importante d’énergie. Il est tout à fait opportun d’en récupérer une grande partie par condensation de cette vapeur.





Répondre
Want to join the discussion?Feel free to contribute!