En cette période hivernale, il est très pratique d’utiliser ces “petites bouillottes” magiques pour se réchauffer les mains. Un petit cours de physique chimie en ligne niveau lycée et vous saurez tout sur leur fonctionnement…
 Karine, e-prof de sciences physiques en ligne va vous décrire ce que contiennent ces poches en plastiques et les phénomènes associés. Ces bouillottes contiennent une pièce métallique et un liquide contenant de l’eau saturée en acétate de sodium (NaCH3CO2). Ces poches ont d’ailleurs fait l’objet d’un sujet d’étude au baccalauréat en Nouvelle Calédonie en 2010 (rattrapage). La synthèse de l’acétate de sodium peut être abordée en Terminale S dans le cadre d’une réaction d’estérification suivie d’une hydrolyse basique.
Karine, e-prof de sciences physiques en ligne va vous décrire ce que contiennent ces poches en plastiques et les phénomènes associés. Ces bouillottes contiennent une pièce métallique et un liquide contenant de l’eau saturée en acétate de sodium (NaCH3CO2). Ces poches ont d’ailleurs fait l’objet d’un sujet d’étude au baccalauréat en Nouvelle Calédonie en 2010 (rattrapage). La synthèse de l’acétate de sodium peut être abordée en Terminale S dans le cadre d’une réaction d’estérification suivie d’une hydrolyse basique.
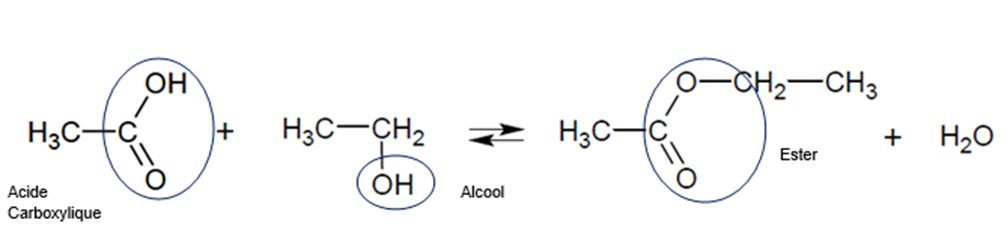
1ere étape : synthèse de l’acétate d’éthyle (Estérification)
acide acétique + éthanol acétate d’éthyle + eau
La réaction d’estérification permet de synthétiser l’acétate d’éthyle (ou éthanoate d’éthyle)
C’est une réaction limitée et donc non totale. Son rendement est de 67 %
Le sujet de baccalauréat Pondichéry 2014 traite de cette réaction d’estérification avec l’étude de son rendement et de son mécanisme réactionnel.
2 ème étape : synthèse de l’acétate de sodium par hydrolyse basique de l’acétate d’éthyle (Saponification)
soude + ester = éthanol + acétate de sodium
Problématique : Quelles masses d’acide acétique et d’éthanol faut-il mélanger pour produire 50g d’acétate de sodium contenu dans une poche ?
M(CH3CO2–,Na+) = 82 g/mol
n (CH3CO2–,Na+) = m/M = 50/82 = 0,61 mol
L’hydrolyse basique étant totale et les coefficients stœchiométriques tous égaux à 1 (mélange équimolaire), il est nécessaire de faire réagir une mole d’ester (acétate d’éthyle) avec une mole de soude pour obtenir une mole d’acétate de sodium et donc de mélanger 0,61 mole de soude avec 0,61 mole d’acétate d’éthyle
L’estérification étant également une réaction équimolaire mais de rendement 67%, il est nécessaire avant tout de mélanger environ 0,91 mol (0.61*100/67) d’acide acétique et 0,91 mol d’éthanol
Sachant que les masses molaires respectives de l’acide acétique et de l’éthanol sont M(CH3COOH) = 60 g/mol et M(C2H6O) = 46 g/mol
Il convient donc de mélanger au départ 54,6 g d’acide acétique ainsi que 41,9 g d’éthanol.
Ci-dessous, une vidéo montrant le dégagement de chaleur lorsque l’on tord la pièce métallique prouvant que la réaction est fortement exothermique :
Dans le cas de la bouillotte magique, on a une solution instable dans laquelle on réussit à dissoudre plus d’acétate de sodium qu’on ne le peut dans des conditions normales ; une partie doit donc précipiter. En tordant la pièce métallique à l’intérieur de la poche, on libère des germes d’acétate de sodium solidifié, ainsi la réaction de précipitation ou cristallisation se déclenche.
La cristallisation est une réaction fortement exothermique ; elle s’accompagne donc d’un dégagement de chaleur, ce qui permet de se réchauffer les mains lors de balades dans la neige !
Afin de pouvoir les réutiliser, on dissout les sels dans de l’eau très chaude, cette dissolution est cette fois-ci une réaction endothermique. L’énergie utilisée lors du chauffage est nécessaire pour rompre la structure cristalline et obtenir l’acétate de sodium en solution.



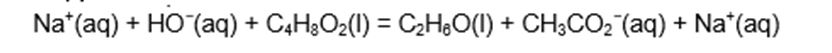


Répondre
Want to join the discussion?Feel free to contribute!