Dans ce dossier en ligne spécial SVT niveau première et terminale scientifique, ton prof de soutien scolaire t’explique tout sur la structure des protéines.
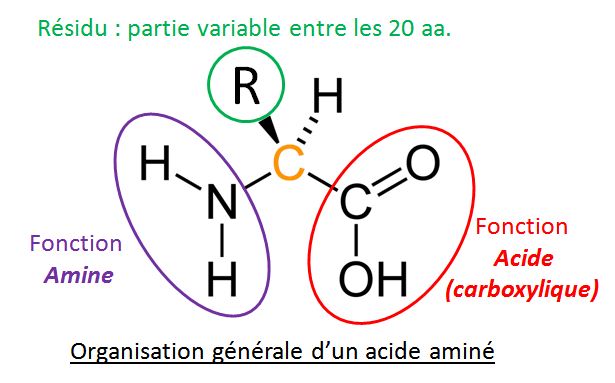
Ces molécules sont constituées par l’enchaînement des acides aminés (notés aa) que l’on peut reconnaître à leur formule générale :
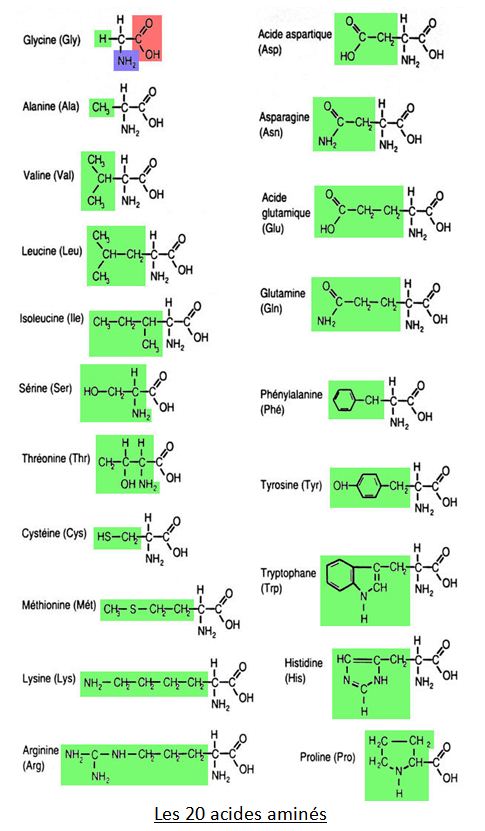
Quels sont les 20 acides aminés ?
Il existe 20 aa que l’on distingue par la nature de leur résidu R qui est à l’origine de propriétés biochimiques différentes :
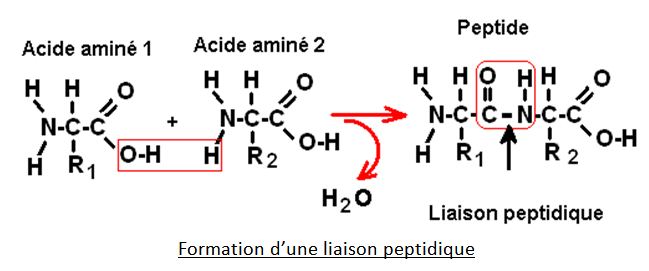
Qu’est-ce qu’une liaison peptidique ?
Lors de la synthèse d’une protéine, il y a formation d’une liaison polypeptidique entre deux acides aminés. Cette liaison se forme par réaction entre les fonctions amine et acide carboxylique de deux acides aminés :
Remarquons que la liaison polypeptidique est une simple liaison ce qui autorise une rotation des deux acides aminés l’un par rapport à l’autre, ce qui a son importance car cette mobilité permettra à la chaîne polypeptidique d’adopter différentes formes dans l’espace selon les conditions de son environnement (en termes de pH et de température notamment).
Si on lie deux aa, on obtient un dipeptide (avec 20 X 20 = 4000 possibilités !).
Si on en enchaîne trois, ce sera un tripeptide (avec 20 X 20 X 20 = 80 000 possibilités !) etc.
On parlera finalement de polypeptide ou chaîne polypeptidique.
Certaines chaînes polypeptidiques sont longues de plusieurs centaines d’aa !
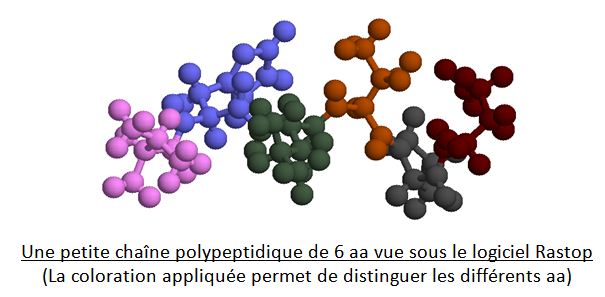
Une petite chaîne polypeptidique de 6 aa vue sous le logiciel Rastop
(La coloration appliquée permet de distinguer les différents aa)
-
L’enchaînement des aa le long du polypeptide s’appelle la séquence.
-
La séquence définit la structure primaire de la chaîne polypeptidique.
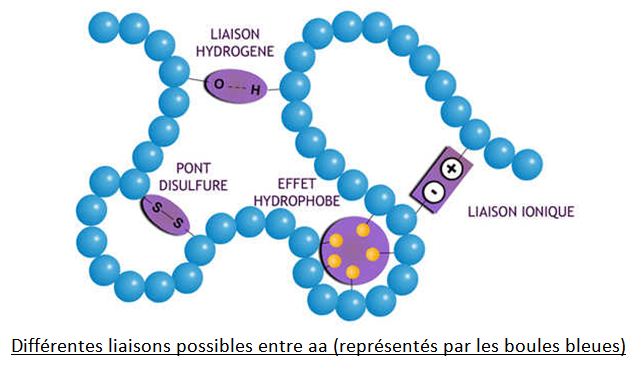
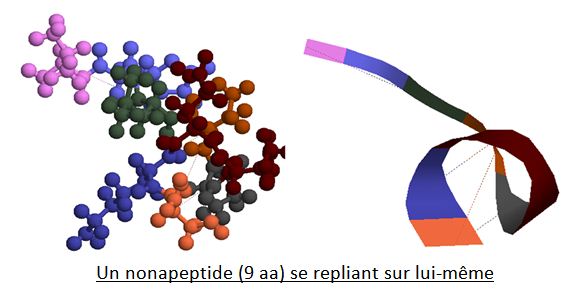
Cependant, les différents résidus des aa qui s’enchaînent peuvent interagir entre eux en s’attirant ou en se repoussant. C’est pourquoi les chaînes polypeptidiques ne restent pas linéaires mais se replient sur elles mêmes dans l’espace :
La représentation de droite, dite en ruban, permet de mieux visualiser le reploiement de la chaîne ; on voit également les liaisons faibles de type liaisons hydrogènes, qui en sont à l’origine, en tirets s’établissant entre différents aa.
D’autres types de liaisons peuvent participer à l’acquisition d’une forme non linéaire :
 Quelle est la différence entre structure secondaire et tertiaire ?
Quelle est la différence entre structure secondaire et tertiaire ?
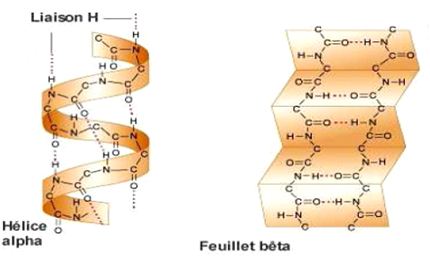
Des chaînes polypeptidiques plus longues vont ainsi adopter des formes 3D complexes de deux types : les hélices α et les feuillets β :
Hélices α et feuillets β forment une structure secondaire des chaînes polypeptidiques. Ensembles, elles permettent de donner aux longs polypeptides une forme 3D complexe : la structure tertiaire.
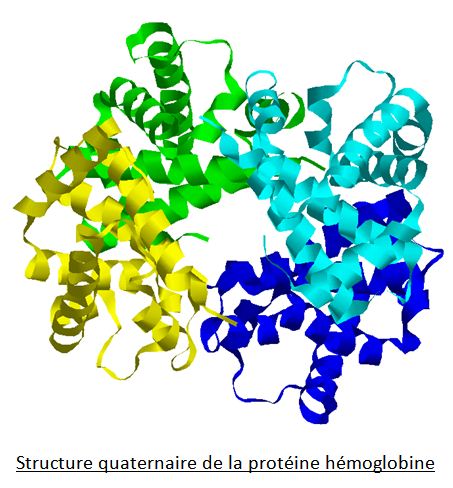
Enfin, différentes chaînes polypeptidiques peuvent s’associer entre elles afin de former une protéine à structure quaternaire :
L’hémoglobine est en effet constituée de 4 chaînes polypeptidiques (identiques 2 à 2) associées entre elles par des liaisons faibles mais nombreuses !
La forme de la protéine dépend donc de sa séquence en aa.
Par quoi cette séquence est-elle déterminée ? Réponse dans notre article de soutien scolaire en ligne sur le Lien entre protéines et gènes : synthèse des protéines. Retrouve également notre article complet sur le rôle des protéines






Répondre
Want to join the discussion?Feel free to contribute!